Resolução inédita da Agência autoriza, por 120 dias, a produção do medicamento usado no tratamento de intoxicações por metanol no Brasil
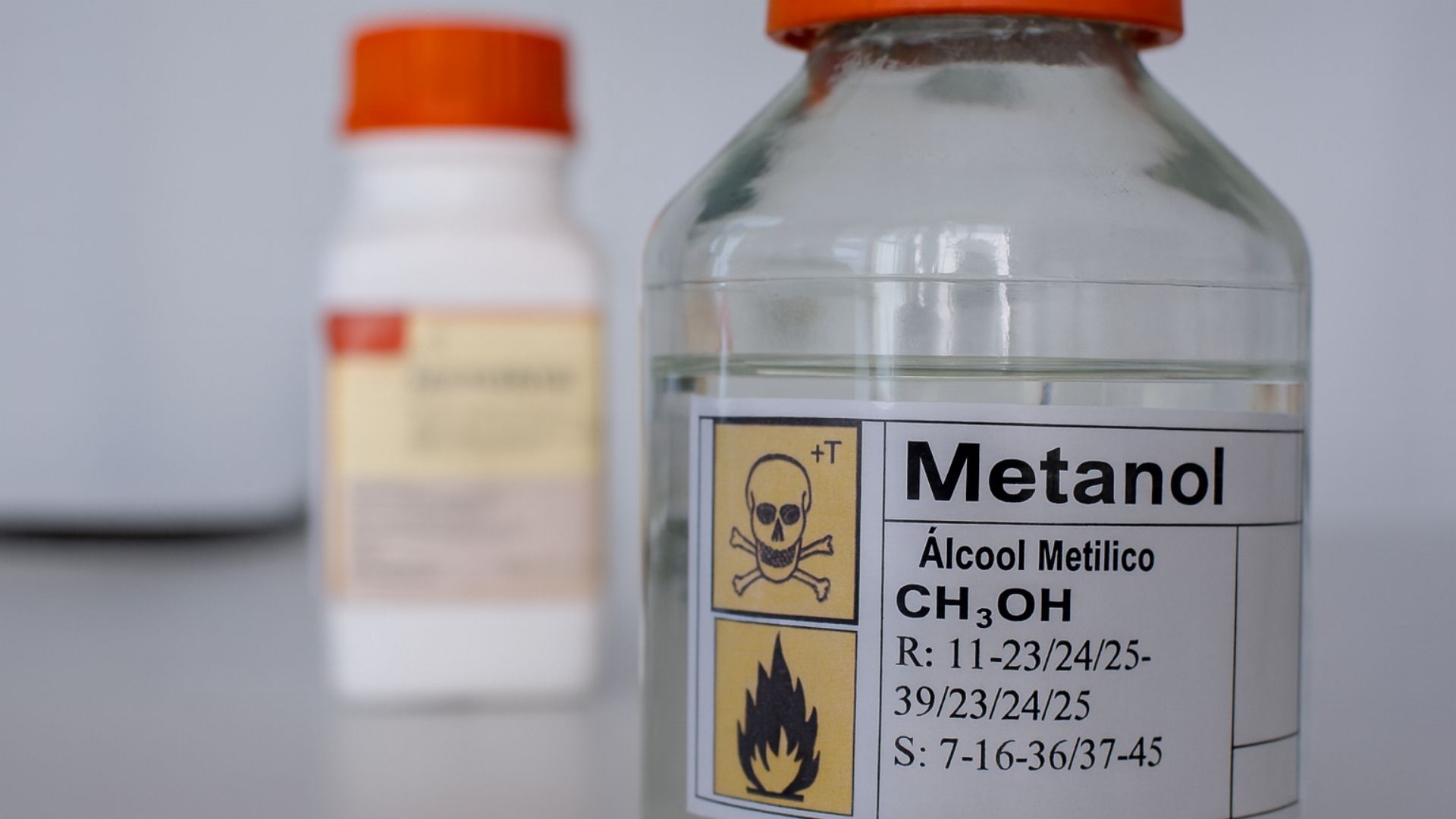
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou, em edição extraordinária do Diário Oficial da União desta sexta-feira (3), a Resolução de Diretoria Colegiada (RDC) nº 994/2025, que autoriza temporariamente a fabricação emergencial de álcool etílico absoluto injetável no país.
A medida foi classificada como “extraordinária e de caráter emergencial” e tem validade inicial de 120 dias, podendo ser prorrogada conforme a necessidade sanitária.
Segundo o texto da resolução, o objetivo é viabilizar o uso do álcool etílico injetável no tratamento de intoxicações por metanol, uma substância altamente tóxica presente em produtos adulterados, solventes e combustíveis. O consumo acidental ou intencional de metanol pode causar cegueira, falência múltipla de órgãos e morte.
-
Como funciona a tinta tecnológica que reflete 97% da luz solar e reduz temperatura em até 6 °C
-
Edifício de 5.000 anos descoberto no Iraque intriga cientistas e pode mudar tudo o que se sabia sobre as origens das cidades e do poder político humano
-
Brasil fará história em 22 de novembro com o lançamento do foguete HANBIT-Nano, primeiro voo orbital comercial do Centro de Lançamento de Alcântara
-
Transforme sua TV velha em smart gastando pouco: veja os aparelhos mais confiáveis e legais para fugir do gatonet e assistir tudo por streaming
Autorização emergencial e isenção de registro
De acordo com o documento, os medicamentos produzidos sob esta regulamentação serão regularizados por meio de notificação, e não precisarão de registro sanitário tradicional, como ocorre em situações normais.
No entanto, as empresas fabricantes deverão possuir certificado válido de Boas Práticas de Fabricação, cumprir os critérios de qualidade da Farmacopeia Brasileira e se responsabilizar integralmente pela segurança, eficácia e rastreabilidade dos produtos.
A Anvisa também determinou que os medicamentos fabricados nessa condição devem ter prazo de validade máximo de 120 dias, manter amostras de três lotes para estudos de estabilidade e enviar amostras para análise de monitoramento em até cinco dias, sempre que solicitado pela Gerência de Laboratórios de Saúde Pública (GELAS) da Agência.
Controle de qualidade e monitoramento técnico
O texto publicado no Boletim Extra do Diário Oficial (Edição 189-A) especifica que a Gerência-Geral de Medicamentos (GGMED) publicará um Guia Produto-Específico, com informações sobre os excipientes permitidos e os requisitos técnicos necessários à administração segura do álcool etílico absoluto injetável.
Além disso, a resolução exige que as empresas mantenham registro de controle de qualidade interno, incluindo resultados de testes de esterilidade e pureza, e notifiquem à Anvisa eventos adversos graves em até 24 horas, conforme os protocolos do Sistema de Notificações em Vigilância Sanitária (Notivisa).
Fiscalização e penalidades
A Anvisa reforçou que poderá suspender a qualquer momento a autorização de fabricação caso sejam detectadas não conformidades sanitárias. O descumprimento das regras da RDC nº 994/2025 configurará infração sanitária, sujeita às penalidades da Lei nº 6.437/1977, que prevê desde multas até interdição da atividade produtiva.
Por que a medida é importante
Casos recentes de intoxicação por metanol vêm sendo registrados em diferentes estados brasileiros, principalmente em decorrência do consumo de bebidas adulteradas. O álcool etílico absoluto injetável é um antídoto eficaz nesses quadros, pois atua competindo com o metanol pela enzima álcool desidrogenase, impedindo a conversão da substância tóxica em ácido fórmico, responsável pelos danos neurológicos e visuais.
A decisão da Anvisa busca garantir o abastecimento nacional desse medicamento, especialmente em hospitais de urgência e centros de toxicologia, que muitas vezes enfrentam escassez de produtos específicos para tratamento de envenenamentos agudos.
A RDC nº 994/2025 foi assinada pelo diretor-presidente Leandro Pinheiro Safatle e entrou em vigor na data de sua publicação, conforme determina o artigo 18 da resolução.

















Seja o primeiro a reagir!